Elektronenpaarbindung
| O2 | N2 | H2 |
| Sauerstoff | Stickstoff | Wasserstoff |
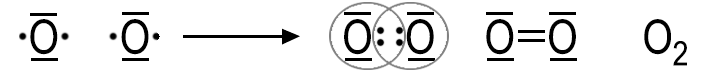
Das Gas Sauerstoff ist immer aus zweiatomigen Molekülen aufgebaut. Dieses Phänomen tritt auch bei anderen Gasen auf, so auch beim Stickstoff oder beim Wasserstoff. Die Ursache ist im Aufbau der Atome zu suchen.
Durch Ausbildung sog. Elektronenpaare zwischen zwei Nichtmetall-Atomen erlangen die Atome in dem neuen Teilchen, Molekül, den Edelgaszustand. Diese Elektronenpaarbindung wird auch Atombindung oder kovalente Bindung genannt.
Zwei Wasserstoff-Atome bilden ein Molekül, indem sie ihr einzelnes Valenzelektron gemeinsam benutzen. So erreichen sie beide für sich gesehen die Edelgaskonfiguration des Heliums, also zwei Elektronen in einer „gefüllten“ Schale:
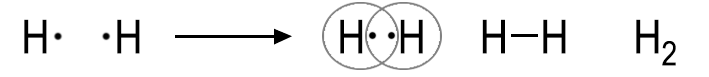
Das gemeinsam benutzte Elektronenpaar wird in der Lewis-Schreibweise durch einen Strich oder durch zwei Punkte dargestellt. Die Strukturformel H-H zeigt im Gegensatz zur Summenformel H2 die Art und Weise wie die Wasserstoff-Atome in einem Molekül miteinander verknüpft sind. Zweiatomige Moleküle bilden beispielsweise Wasserstoff und Stickstoff, sowie die Chalkogene und die Halogene. Zwei Bindungspartner können wie beim Sauerstoff-Molekül auch durch zwei Elektronenpaarbindungen miteinander verbunden sein. Es handelt sich in dann um eine Doppelbindung.
Bei Dreifachbindungen sind Atome durch drei Elektronenpaarbindungen miteinander verbunden.